Konzept von Quantum Dot (QD)-basierter Templat-katalysierter RNA Detektion
Quelle: BAM, Fachbereich Biophotonik und Humboldt-Universität zu Berlin, Institut für Chemie
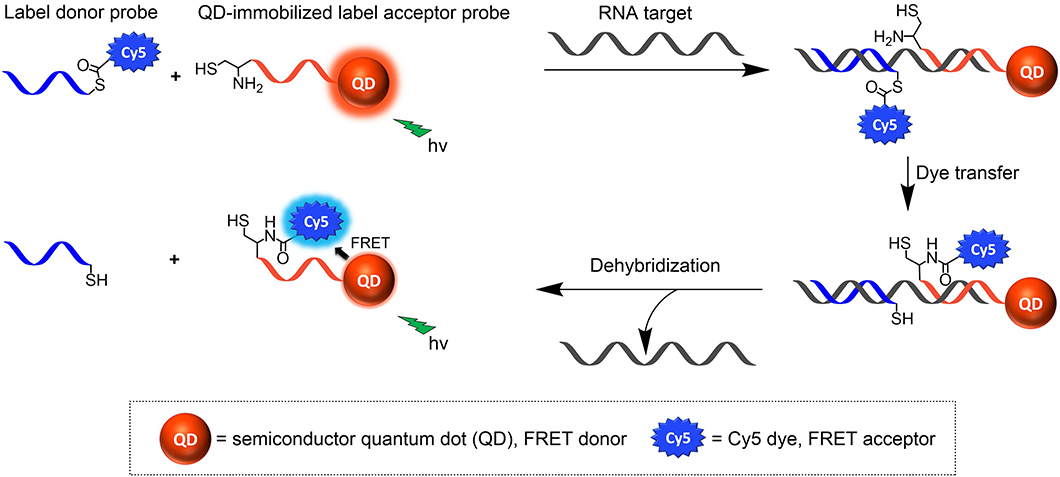
Oligonukleotid-vermittelte Reaktionen (OVR) zwischen zwei reaktiven Hybridisierungs-Sonden verwenden eine RNA- oder DNA-Zielsequenz als Katalysator der chemischen Reaktion und ermöglichen so eine sensitive Detektion dieser RNA oder DNA. Normalerweise werden OVRs so entwickelt, dass die Reaktionsprodukte fluoreszieren als Voraussetzung für eine fluorometrische Detektion. Die meisten OVRs verwenden zur Erzeugung des Fluoreszenzsignals zwei mit unterschiedlichen organischen Farbstoffen markierte Sonden, die i.a. ein Energietransferpaar bilden. Organische Farbstoffe besitzen jedoch oft nur eine moderate Helligkeit, was die Größe der bei niedrigen Sonden-Konzentrationen resultierenden optischen Signale limitiert und damit die erreichbare Nachweisgrenze. Das Verwenden von sehr hellen Nanopartikeln wie Halbleiterquantenpunkten (sogenannte Quantum Dots, QDs) anstelle organischer Farbstoffe kann die Sensitivität der RNA- oder DNA-Detektion mit OVRs verbessern, gerade im Bereich sehr niedriger Konzentrationen der Sonden und somit die Assay-Performance. Die vorliegende Publikation beschreibt die Entwicklung einer OVR für ein RNA-Target, z.B. die RNA eines Virus, die zwischen zwei Peptidnukleinsäure (peptide nucleic acid, PNA)-basierten Sonden auf der Oberfläche eines fluoreszenten Polymer-funktionalisierten CdSe/ZnS QDs erfolgt. Dabei fungiert die auf dem QD immobilisierte PNA, die ein Cystein am Terminus trägt, als Label Akzeptor-Sonde („label acceptor“ probe). Die Label Donor- PNA-Sonde („label donor“ probe) wurde mit dem organischen Farbstoff Cy5 über eine Thioester-Bindung funktionalisiert. Der CdSe QD wurde so ausgewählt, dass seine Emission mit der Absorptionsbande von Cy5 spektral überlappt. Wie in Abb. 1 dargestellt, führt die benachbarte Hybridisierung der beiden Sonden am RNA-Target zum Transfer von Cy5 auf die an den QD gebundenen PNA-Sequenzen. Die räumliche Nähe von Cy5 und CdSe QD ermöglicht einen Förster−Resonanzenergietransfer-Prozess (FRET) zwischen beiden Fluorophoren, bei dem die Fluoreszenz des optisch angeregten QD-Donors zur (strahlungslosen) Anregung der Emission des längerwellig leuchtenden Cy5 eingesetzt wird. Dieser FRET-Prozess zeigt selektiv und sensitiv die Anwesenheit der RNA-Zielsequenz an. Dieser Assay kann in einer Mikrotiterplatte durchgeführt und mit einem Fluoreszenzreaders ausgelesen werden. Solche Assays sind auch gut für die Point-of-Care Diagnostik mittels Schnelltests geeignet.
Reactive Quantum Dot-Based FRET Systems for Target-Catalyzed Detection of RNA
Oleksandr Zavoiura, Ute Resch-Genger, Oliver Seitz, erschienen in Peptide Nucleic Acids. Methods in Molecular Biology, Vol. 2105, pp 187-189, 2020
BAM Fachbereich Biophotonik


